Trudno stwierdzić, czy każdego interesuje to, potencjalnie jak długo będzie żył. Z pewnością jednak dla wielu informacja o ich obecnym stanie zdrowia, o biologicznym wieku, byłaby ciekawa i być może przydatna. Jak zatem ocenia się wiek biologiczny? Czym jest starzenie się organizmu? Jakie są hipotezy dotyczące przyczyn starzenia się? I dlaczego w ogóle się starzejemy?


Czym właściwie jest starość?
Należy odróżnić śmierć ze starości od śmierci na skutek choroby. Przykładowy
stulatek może umrzeć przez infekcję, bo jego układ odpornościowy nie był już w
stanie sobie z nią poradzić. Ale jak długo żyłby, gdyby miał idealne warunki?
Gdyby nie był narażony na choroby zakaźne, upadki itp.? Na ile pozwoliłoby mu
jego własne DNA, jego komórki, jego metabolizm? To byłaby właśnie prawdziwa
śmierć ze starości. Warto odróżniać znaczenia pojęcia nieśmiertelności – to
bardziej realistyczne, czyli zaprzestanie starzenia się naszego DNA, komórek i
organizmu – od fantastycznej nieśmiertelności, gdzie żadna broń atomowa nie
jest w stanie zabić domniemanego szczęśliwca. Istnieją organizmy, które faktycznie zdają się nie starzeć (idzie im to bardzo wolno). Zjawisko takie nazywa się zaniedbywalnym starzeniem. Nie zaobserwowano go niestety u ssaków, a jedynie roślin, bezkręgowców, ryb, płazów i gadów.
Należy odróżnić śmierć ze starości od śmierci na skutek choroby. Przykładowy
stulatek może umrzeć przez infekcję, bo jego układ odpornościowy nie był już w
stanie sobie z nią poradzić. Ale jak długo żyłby, gdyby miał idealne warunki?
Gdyby nie był narażony na choroby zakaźne, upadki itp.? Na ile pozwoliłoby mu
jego własne DNA, jego komórki, jego metabolizm? To byłaby właśnie prawdziwa
śmierć ze starości. Warto odróżniać znaczenia pojęcia nieśmiertelności – to
bardziej realistyczne, czyli zaprzestanie starzenia się naszego DNA, komórek i
organizmu – od fantastycznej nieśmiertelności, gdzie żadna broń atomowa nie
jest w stanie zabić domniemanego szczęśliwca. Istnieją organizmy, które faktycznie zdają się nie starzeć (idzie im to bardzo wolno). Zjawisko takie nazywa się zaniedbywalnym starzeniem. Nie zaobserwowano go niestety u ssaków, a jedynie roślin, bezkręgowców, ryb, płazów i gadów.
 |
| Odmieniec jaskiniowy. Gatunek starzejący się zaniedbywalnie. Fot. Boštjan Burger |
Najpierw chciałbym opowiedzieć
trochę o starzeniu się w ogóle. Przyczyn tego zjawiska dopatruje się wśród co
najmniej kilku mechanizmów. Najbardziej (tradycyjnie już) eksponuje się
reaktywne formy tlenu, wolne rodniki, które uszkadzają DNA, białka i błony
komórkowe. Indukują powstawanie mutacji, są przyczyną stanów zapalnych i niesprawności
komórek (choć warto wiedzieć też, że pełnią w zwierzęcych organizmach również
potrzebne funkcje, np. sygnalizacyjne i mobilizacyjne). Mimo to w chwili
obecnej wolne rodniki uznawane są przez biologów tylko za jeden z czynników
powodujących starzenie, ale nie decydujący, czemu dowiodły różnorodne badania,
w tym na zmutowanych gryzoniach z manipulacjami stężenia wolnych rodników oraz
w eksperymentach przy użyciu antyutleniaczy.
trochę o starzeniu się w ogóle. Przyczyn tego zjawiska dopatruje się wśród co
najmniej kilku mechanizmów. Najbardziej (tradycyjnie już) eksponuje się
reaktywne formy tlenu, wolne rodniki, które uszkadzają DNA, białka i błony
komórkowe. Indukują powstawanie mutacji, są przyczyną stanów zapalnych i niesprawności
komórek (choć warto wiedzieć też, że pełnią w zwierzęcych organizmach również
potrzebne funkcje, np. sygnalizacyjne i mobilizacyjne). Mimo to w chwili
obecnej wolne rodniki uznawane są przez biologów tylko za jeden z czynników
powodujących starzenie, ale nie decydujący, czemu dowiodły różnorodne badania,
w tym na zmutowanych gryzoniach z manipulacjami stężenia wolnych rodników oraz
w eksperymentach przy użyciu antyutleniaczy.
Każdy zastanawia się zapewne czy
spożywanie dodatkowych ilości przeciwutleniaczy w postaci specjalnych pokarmów
czy suplementów diety ma sens, skoro wolne rodniki zdają się być jednym z
wrogów młodości. Odpowiedź nie jest jednoznaczna, a w zasadzie to prawie wcale
jej nie ma. Wiele może zależeć od stanu organizmu. Niektórzy mają wzmożoną
ekspresję enzymów przeciwutleniających, takich jak dysmutaza ponadtlenkowa czy
peroksydaza glutationowa albo oksygenaza hemowa. Poza tym nasze endogenne
przeciwutleniacze są na pewno ważniejsze od tych egzogennych, czerpanych z
pożywienia, a wzmożone pobieranie tych drugich być może zmniejsza ekspresję
tych pierwszych, co raczej uznaje się za niekorzystne. W związku z tym łykanie
dodatkowych przeciwutleniaczy nie zawsze okaże się być dobre. Istnieją
publikacje z epidemiologicznych badań, w których pokazano że występuje
korelacja pomiędzy dodatkowym spożywaniem witaminy E czy beta karotenu, a
krótszym życiem. Moda na zjadanie przeciwutleniaczy – jakichkolwiek,
kiedykolwiek i z czegokolwiek, byle były – wygląda na merytorycznie bezzasadną.
spożywanie dodatkowych ilości przeciwutleniaczy w postaci specjalnych pokarmów
czy suplementów diety ma sens, skoro wolne rodniki zdają się być jednym z
wrogów młodości. Odpowiedź nie jest jednoznaczna, a w zasadzie to prawie wcale
jej nie ma. Wiele może zależeć od stanu organizmu. Niektórzy mają wzmożoną
ekspresję enzymów przeciwutleniających, takich jak dysmutaza ponadtlenkowa czy
peroksydaza glutationowa albo oksygenaza hemowa. Poza tym nasze endogenne
przeciwutleniacze są na pewno ważniejsze od tych egzogennych, czerpanych z
pożywienia, a wzmożone pobieranie tych drugich być może zmniejsza ekspresję
tych pierwszych, co raczej uznaje się za niekorzystne. W związku z tym łykanie
dodatkowych przeciwutleniaczy nie zawsze okaże się być dobre. Istnieją
publikacje z epidemiologicznych badań, w których pokazano że występuje
korelacja pomiędzy dodatkowym spożywaniem witaminy E czy beta karotenu, a
krótszym życiem. Moda na zjadanie przeciwutleniaczy – jakichkolwiek,
kiedykolwiek i z czegokolwiek, byle były – wygląda na merytorycznie bezzasadną.
 |
| Przeciwutleniacze w tabletkach; suplementy diety. |
W procesie starzenia za następny
czynnik uznaje się telomery, a właściwie ich degradację. Są to końcówki
chromosomów, chroniące je przed uszkodzeniami, łączeniem się w chromosomy „pierścieniowe”
i innymi molekularnymi patologiami strukturalnymi i dysfunkcjami. Jak to się
dzieje, że telomery zabezpieczają chromosomy? Nasi odlegli przodkowie mieli
koliste DNA, w związku z czym replikacja zachodziła od pierwszego do ostatniego
nukleotydu. U większości prokariontów tak jest do dnia dzisiejszego. Chromosomy
eukariontów ewoluowały jednak w struktury nitkowate. Każda ich kolejna
replikacja wiąże się więc z utratą drobnego, końcowego fragmentu chromosomu. Musiało
zatem powstać coś, co zabezpieczy komórkę przed zbyt szybkim zanikiem funkcjonalnych
genów po określonej liczbie replikacji. Zamiast nich ubywa więc nie sekwencji kodujących,
a właśnie telomerów. Dla prostego zobrazowania tej funkcji telomery zwykle
porównuje się do końcówek sznurowadeł, dzięki czemu te się nie prują. Z wiekiem
nasze telomery ulegają zmianom, skracają się. Ich odbudowywanie jest coraz
słabsze, mniej efektywne (z wyjątkiem komórek nowotworowych, w których gen
kodujący enzym korygujący telomery – telomeraza – wykazuje bardzo wysoką
ekspresję). Proces ten jest jedną ze składowych starzenia się organizmu.
czynnik uznaje się telomery, a właściwie ich degradację. Są to końcówki
chromosomów, chroniące je przed uszkodzeniami, łączeniem się w chromosomy „pierścieniowe”
i innymi molekularnymi patologiami strukturalnymi i dysfunkcjami. Jak to się
dzieje, że telomery zabezpieczają chromosomy? Nasi odlegli przodkowie mieli
koliste DNA, w związku z czym replikacja zachodziła od pierwszego do ostatniego
nukleotydu. U większości prokariontów tak jest do dnia dzisiejszego. Chromosomy
eukariontów ewoluowały jednak w struktury nitkowate. Każda ich kolejna
replikacja wiąże się więc z utratą drobnego, końcowego fragmentu chromosomu. Musiało
zatem powstać coś, co zabezpieczy komórkę przed zbyt szybkim zanikiem funkcjonalnych
genów po określonej liczbie replikacji. Zamiast nich ubywa więc nie sekwencji kodujących,
a właśnie telomerów. Dla prostego zobrazowania tej funkcji telomery zwykle
porównuje się do końcówek sznurowadeł, dzięki czemu te się nie prują. Z wiekiem
nasze telomery ulegają zmianom, skracają się. Ich odbudowywanie jest coraz
słabsze, mniej efektywne (z wyjątkiem komórek nowotworowych, w których gen
kodujący enzym korygujący telomery – telomeraza – wykazuje bardzo wysoką
ekspresję). Proces ten jest jedną ze składowych starzenia się organizmu.
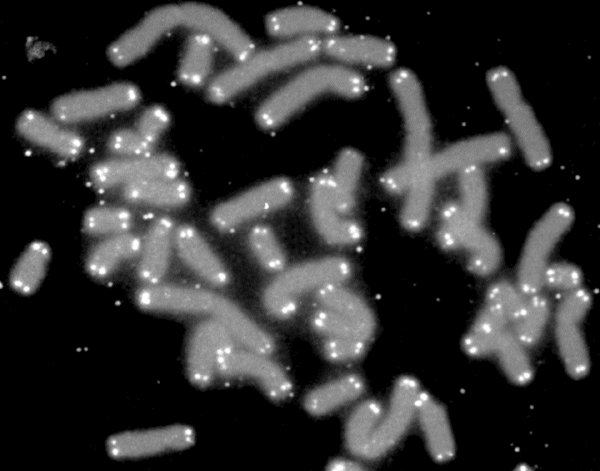 |
| Chromosomy z oznakowanymi telomerami. Fot. U.S. Department of Energy Human Genome Program |
Efekt starzeniowy przypisuje się
także insulinie i insulinopodobnym czynnikom wzrostu (znanym pod skrótem IGF
– insuline growth factors). Hormon
ten wydzielany jest przez wyspy beta trzustki, a szczytowy moment następuje kiedy się najemy. Cukry uwolnione
z pokarmu podczas trawienia zostają wchłonięte i trafiają do krwioobiegu, a
dalej do komórek. Jest to więc informacja, że organizm jest w formie, gdyż
poradził sobie ze zdobyciem pożywienia. Sygnał ten prawdopodobnie kształtował
się ewolucyjnie jako objaw możliwości przystąpienia do rozrodu, a z hipotezy
dyspozycyjnego ciała wynika, że organizm musi równoważyć wydatki na utrzymanie
ciała i na rozród. Kiedy zatem dostaje wiadomość, że jest okazja by się
rozmnażać, więcej energii poświęcane jest na ekspresję genów ważnych w
behawiorze seksualnym itp. Odbywa się to kosztem energii przeznaczonej na
przykład na syntezę enzymów przeciwutleniających czy białek naprawczych w
komórkach somatycznych. Co więcej, geny, które w młodym wieku są przydatne i
pomagają przetrwać, w późniejszym okresie życia mogą negatywnie wpływać na
zdrowie i żywotność. Tym samym dobór naturalny promuje większe szanse na
przetrwanie w młodości, kosztem długiego życia. Koncepcja ta ubrana jest w
zestaw twierdzeń, w postaci tezy antagonistycznej plejotropii.
także insulinie i insulinopodobnym czynnikom wzrostu (znanym pod skrótem IGF
– insuline growth factors). Hormon
ten wydzielany jest przez wyspy beta trzustki, a szczytowy moment następuje kiedy się najemy. Cukry uwolnione
z pokarmu podczas trawienia zostają wchłonięte i trafiają do krwioobiegu, a
dalej do komórek. Jest to więc informacja, że organizm jest w formie, gdyż
poradził sobie ze zdobyciem pożywienia. Sygnał ten prawdopodobnie kształtował
się ewolucyjnie jako objaw możliwości przystąpienia do rozrodu, a z hipotezy
dyspozycyjnego ciała wynika, że organizm musi równoważyć wydatki na utrzymanie
ciała i na rozród. Kiedy zatem dostaje wiadomość, że jest okazja by się
rozmnażać, więcej energii poświęcane jest na ekspresję genów ważnych w
behawiorze seksualnym itp. Odbywa się to kosztem energii przeznaczonej na
przykład na syntezę enzymów przeciwutleniających czy białek naprawczych w
komórkach somatycznych. Co więcej, geny, które w młodym wieku są przydatne i
pomagają przetrwać, w późniejszym okresie życia mogą negatywnie wpływać na
zdrowie i żywotność. Tym samym dobór naturalny promuje większe szanse na
przetrwanie w młodości, kosztem długiego życia. Koncepcja ta ubrana jest w
zestaw twierdzeń, w postaci tezy antagonistycznej plejotropii.
Badania pokazują, że istotnie na
tempo starzenia się wpływa liczba spożywanych kalorii. Ograniczenie zjadanego
pokarmu wydłuża życie u gryzoni laboratoryjnych w sposób znaczny, a u ludzi
podobne obserwacje poczyniono na podstawie analiz epidemiologicznych. Wiąże się
to najprawdopodobniej z mniejszym ryzykiem pojawienia się otyłości,
występowania chorób sercowo-naczyniowych, stanów zapalnych, nowotworów. Być
może fenomen ten powiązany jest w jakiś sposób z mechanizmem insulinowym,
opisanym wyżej. Wiadomo natomiast, że restrykcja kaloryczna może korzystnie
wpływać na regulację i aktywność sirtuin, „białek młodości” (stymulowanych
także przez resweratrol).
tempo starzenia się wpływa liczba spożywanych kalorii. Ograniczenie zjadanego
pokarmu wydłuża życie u gryzoni laboratoryjnych w sposób znaczny, a u ludzi
podobne obserwacje poczyniono na podstawie analiz epidemiologicznych. Wiąże się
to najprawdopodobniej z mniejszym ryzykiem pojawienia się otyłości,
występowania chorób sercowo-naczyniowych, stanów zapalnych, nowotworów. Być
może fenomen ten powiązany jest w jakiś sposób z mechanizmem insulinowym,
opisanym wyżej. Wiadomo natomiast, że restrykcja kaloryczna może korzystnie
wpływać na regulację i aktywność sirtuin, „białek młodości” (stymulowanych
także przez resweratrol).
 |
| Winorośl; winogrona bogate są w resweratrol. |
Nagromadzenie się mutacji
genetycznych na skutek działania wolnych rodników czy nienaprawionych błędów występujących
podczas replikacji powoduje, że aparat genetyczny wytwarza wadliwe RNA i
białka, przez co organizm nie jest w stanie normalnie funkcjonować, bronić się
przed infekcjami i dalszymi atakami wolnych rodników. Zaburzona zostaje
proteostaza, czyli właściwe powstawanie, funkcjonowanie i regulowanie
aktywności białek. Może zacząć się też proces nowotworzenia. Komórki popełniają
apoptozę (programowaną śmierć) i serce na skutek tego po latach pracy traci
sprawność. Kumulacja mutacji w DNA jest więc kolejnym elementem starzenia się
organizmu.
genetycznych na skutek działania wolnych rodników czy nienaprawionych błędów występujących
podczas replikacji powoduje, że aparat genetyczny wytwarza wadliwe RNA i
białka, przez co organizm nie jest w stanie normalnie funkcjonować, bronić się
przed infekcjami i dalszymi atakami wolnych rodników. Zaburzona zostaje
proteostaza, czyli właściwe powstawanie, funkcjonowanie i regulowanie
aktywności białek. Może zacząć się też proces nowotworzenia. Komórki popełniają
apoptozę (programowaną śmierć) i serce na skutek tego po latach pracy traci
sprawność. Kumulacja mutacji w DNA jest więc kolejnym elementem starzenia się
organizmu.
Także działalność mitochondriów
staje się z czasem dysfunkcyjna przez zachodzące w mtDNA mutacje. Proces
starzenia się naszych mitochondriów można w pewnym stopniu spowolnić i to w
prosty i oczywisty sposób – ćwiczeniami. Kiedy dbamy o regularną aktywność
fizyczną, mitochondria „chętniej” się dzielą. Powstają więc nowe i nowe. Jeżeli
namnożymy ich sobie więcej w młodszym wieku, kiedy są jeszcze zdrowe, z
niewielką liczbą mutacji, to na przyszłość mamy więcej pożądanych
mitochondriów. M.in. właśnie takim mechanizmem (choć nie tylko) tłumaczy się
korzystny wpływ aktywności fizycznej na długość życia.
staje się z czasem dysfunkcyjna przez zachodzące w mtDNA mutacje. Proces
starzenia się naszych mitochondriów można w pewnym stopniu spowolnić i to w
prosty i oczywisty sposób – ćwiczeniami. Kiedy dbamy o regularną aktywność
fizyczną, mitochondria „chętniej” się dzielą. Powstają więc nowe i nowe. Jeżeli
namnożymy ich sobie więcej w młodszym wieku, kiedy są jeszcze zdrowe, z
niewielką liczbą mutacji, to na przyszłość mamy więcej pożądanych
mitochondriów. M.in. właśnie takim mechanizmem (choć nie tylko) tłumaczy się
korzystny wpływ aktywności fizycznej na długość życia.
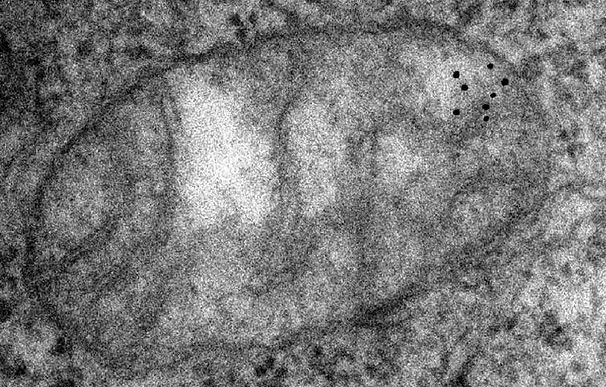 |
| Mitochondrium z uwidocznionym mtDNA. Zdjęcie wykonane za pomocą mikroskopii elektronowej. Fot. Francisco J. Iborra, Hiroshi Kimura, Peter R. Cook |
Istnieje jeszcze epigenetyczny zegar biologiczny. Opiera
się on o metylację DNA w regionach wysp CpG, czyli sekwencjach bogatych w
powtórzenia cytozyna-guanina (dinukleotydy). Dla wyjaśnienia – metylacja DNA to
proces przyłączania do nukleotydów, zwykle cytozyn (czasem też adenin) grupy
alkilowej (CH3), zwanej również metylową. Fragmenty chromosomów,
gdzie poziom metylacji jest wysoki, są silniej upakowane (skondensowane), a to
ogranicza dostęp do nich dla czynników transkrypcyjnych. W związku z tym
ekspresja zmetylowanych genów jest zmniejszona lub całkowicie ograniczona. Wzór
metylacji DNA może być epigenetycznie dziedziczony. Zmienia się także wraz z
wiekiem i to z tej właściwości czerpie biologiczny zegar epigenetyczny.
się on o metylację DNA w regionach wysp CpG, czyli sekwencjach bogatych w
powtórzenia cytozyna-guanina (dinukleotydy). Dla wyjaśnienia – metylacja DNA to
proces przyłączania do nukleotydów, zwykle cytozyn (czasem też adenin) grupy
alkilowej (CH3), zwanej również metylową. Fragmenty chromosomów,
gdzie poziom metylacji jest wysoki, są silniej upakowane (skondensowane), a to
ogranicza dostęp do nich dla czynników transkrypcyjnych. W związku z tym
ekspresja zmetylowanych genów jest zmniejszona lub całkowicie ograniczona. Wzór
metylacji DNA może być epigenetycznie dziedziczony. Zmienia się także wraz z
wiekiem i to z tej właściwości czerpie biologiczny zegar epigenetyczny.
Współcześnie jesteśmy w stanie oszacować względny, biologiczny wiek organizmu na podstawie parametrów takich jak uszkodzenia DNA, długość telomerów czy stopień metylacji dinukleotydów w wyspach CpG. Zjawisko starzenia ewoluowało miliony lat. Odpowiedzi na
postawione na początku artykułu pytania wymagają więc odniesienia się do biologii ewolucyjnej. Jest to dobry przykład tego, jak ważna może się ona okazać w
medycynie czy dietetyce. Wątek ten przypomina nam też, że bezmyślne podążanie
za modą na przeciwutleniacze, jako eliksiry młodości, niekoniecznie jest słuszne. Warto śledzić dalsze postępy naukowe w odkrywaniu, czym dokładniej jest starzenie, jakie są tego przyczyny i jak można im zapobiegać.
postawione na początku artykułu pytania wymagają więc odniesienia się do biologii ewolucyjnej. Jest to dobry przykład tego, jak ważna może się ona okazać w
medycynie czy dietetyce. Wątek ten przypomina nam też, że bezmyślne podążanie
za modą na przeciwutleniacze, jako eliksiry młodości, niekoniecznie jest słuszne. Warto śledzić dalsze postępy naukowe w odkrywaniu, czym dokładniej jest starzenie, jakie są tego przyczyny i jak można im zapobiegać.
Ponieważ prowadzenie bloga naukowego wymaga ponoszenia kosztów (nie tylko finansowych, ale także czasowych), zdecydowałem się stworzyć profil na Patronite, gdzie możecie ustawić w prosty sposób comiesięczne wpłaty na rozwój bloga. Dzięki temu może on funkcjonować i będzie lepiej się rozwijać (pojawia się dzięki temu więcej artykułów na blogu). 5 czy 10 złotych nie jest dla jednej osoby dużą kwotą, ale przy wsparciu wielu z Was staje się realnym, finansowym patronatem bloga.
Literatura
Baur, Joseph A., et al. „Resveratrol improves health and
survival of mice on a high-calorie diet.” Nature (2006): 337.
survival of mice on a high-calorie diet.” Nature (2006): 337.
Bjelakovic, Goran, et al.
„Mortality in randomized trials of antioxidant supplements for primary and
secondary prevention: systematic review and meta-analysis.” Jama
(2007): 842-857.
„Mortality in randomized trials of antioxidant supplements for primary and
secondary prevention: systematic review and meta-analysis.” Jama
(2007): 842-857.
Corton, J. Christopher, et al.
„Mimetics of caloric restriction include agonists of lipid-activated
nuclear receptors.” Journal of Biological Chemistry (2004):
46204-46212.
„Mimetics of caloric restriction include agonists of lipid-activated
nuclear receptors.” Journal of Biological Chemistry (2004):
46204-46212.
Douglas J. Futuyma. Ewolucja.
Wydawnictwo Uniwersytetu Warszawskiego. Warszawa 2008.
Wydawnictwo Uniwersytetu Warszawskiego. Warszawa 2008.
Goel, Neelam, Priya Karir, and
Vivek Kumar Garg. „Role of DNA methylation in human age
prediction.” Mechanisms of ageing and development (2017): 33-41.
Vivek Kumar Garg. „Role of DNA methylation in human age
prediction.” Mechanisms of ageing and development (2017): 33-41.
Horvath, Steve. “DNA Methylation
Age of Human Tissues and Cell Types.” Genome Biology (2013): R115. Web. 5
May 2018.
Age of Human Tissues and Cell Types.” Genome Biology (2013): R115. Web. 5
May 2018.
http://genomics.senescence.info/species/nonaging.php
Kirkwood, Tom B. „Evolution of
ageing.” Nature (1977): 301-304.
Kirkwood, Tom B. „Evolution of
ageing.” Nature (1977): 301-304.
Lapointe, Jérôme, and Siegfried
Hekimi. “When a Theory of Aging Ages Badly.” Cellular and molecular life
sciences : CMLS (2010): 1–8. PMC. Web. 5 May 2018.
Hekimi. “When a Theory of Aging Ages Badly.” Cellular and molecular life
sciences : CMLS (2010): 1–8. PMC. Web. 5 May 2018.
Nick Lane. Tlen, cząsteczka, która
stworzyła świat. Wydawnictwo Prószyński i S-ka. Warszawa.
stworzyła świat. Wydawnictwo Prószyński i S-ka. Warszawa.
Robert Murray, Daryl
Granner, Victor Rodwell. Biochemia Harpera. Wydawnictwo Lekarskie
PZWL. Warszawa 2014.
Granner, Victor Rodwell. Biochemia Harpera. Wydawnictwo Lekarskie
PZWL. Warszawa 2014.
Sanz, Alberto, and Rhoda KA
Stefanatos. „The mitochondrial free radical theory of aging: a critical
view.” Current aging science (2008): 10-21.
Stefanatos. „The mitochondrial free radical theory of aging: a critical
view.” Current aging science (2008): 10-21.
Tadeusz Krzymowski. Fizjologia zwierząt. Państwowe
Wydawnictwo Rolnicze i Leśne. Warszawa 2005.
Wydawnictwo Rolnicze i Leśne. Warszawa 2005.
Winter P., Hickey I., Fletcher
H. Krótkie wykłady. Genetyka. Wydawnictwo Naukowe PWN. Warszawa 2013.
H. Krótkie wykłady. Genetyka. Wydawnictwo Naukowe PWN. Warszawa 2013.











Wielki temat, na który nasza wiedza zmienia się bardzo dynamicznie! Przeczuwam salwy protekcjonalnego śmiechu, które będą wybuchały za kilkadziesiąt lat – tak, jak dziś śmiejemy się z dawnego rozumowania, jakby było jakąś mitologią. 🙂
Czy ja wiem? Niektóre dobre rady naszych pradziadków są nadal aktualne, nawet jeśli wyrażane językiem już dla nas archaicznym.
Pierwszy od dawna post bez ideologi… Brawo!
Sam temat oczywiście nośnymi ważny. Wszystko uklada się w logiczny, ewolucyjne uzasadniony model. Pewnie niejednego się jeszcze dowiemy, ale to co wiemy już teraz, daje sensowny obraz.
Ideologii? Jakiś przykład?
Czego przyklad? Przyklad braku ideologii?
Przy okazji "skuteczności" antyoksydantów – jako "eliksiru młodości", który rozwinąłeś to napomknę, że można by jeszcze wspomnieć, że w 2017 odkryto białko P53, które "cofa" efekty starzenia – czyli uniemożliwia starzejącym się komórkom dalszy podział. Myślę, że to ciekawe odkrycie i warte odnotowania w powyższym tekście. (Zwłaszcza, że daję nadzieję na walkę z rakiem)
Tak czy siak fajny artykuł. Często mi ręce opadają jak moje zachwycone koleżanki – zachwycone "wynikami" testów gazetowych czy innych "cudownych maszyn"- tryskając euforyczną wręcz radością, oznajmiają mi, że: "ale tak BIOLOGICZNIE" to one tak NAPRAWDĘ mają po 15-17 lat. 😀
radosc przedluza zycie wielokrotnie to udowodniono
Bialko p53 odkryto w latach 70tych