
Epigenetyka i metylacja DNA
genetyki i zajmuje się zmianami ekspresji genów (czyli nasilenia ich odczytywania;
na ekspresję genów składa się transkrypcja, a więc przepisywanie DNA na RNA
oraz translacja, czyli przepisywanie RNA na białka) wynikającą nie z sekwencji
nukleotydów (tzw. cegiełek DNA; adeniny, tyminy, guaniny i cytozyny), ale ich
chemicznych modyfikacji oraz zmian białek histonowych, na które nić DNA jest
nawinięta. Należą do nich przede wszystkim metylacja (dodawanie grupy
metylowej), acetylacja (dodawanie grupy acetylowej), ubikwitynacja (dodawanie
ubikwityny) czy fosforylacja.
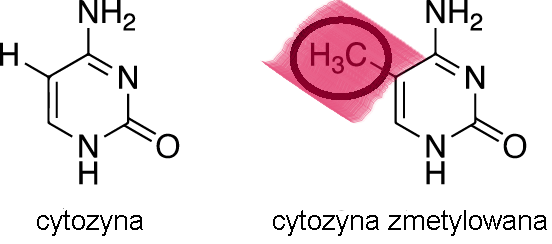
zmetylowany (a dokładnie cytozyny, które zawiera, bo to przede wszystkim ten
nukleotyd ulega metylacji) to jego ekspresja jest niższa lub całkowicie
zablokowana. Z kolei gdy grup metylowych jest w nim niewiele, to transkrypcja
(ekspresja genów) ma szanse iść pełną parą. Wynika to z faktu, że metylacja DNA
prowadzi do skondensowania (uciśnienia) fragmentów DNA nawiniętych na białka
histonowe (które wspólnie tworzą chromatynę, stąd mówi się o kondensacji
chromatyny), przez co trudniej dostać się do nich czynnikom transkrypcyjnym i
zainicjować transkrypcję. Jeśli zaś chodzi o zmiany białek histonowych
(histonów), to tutaj typów modyfikacji jest znacznie więcej i wpływają one na
ekspresję DNA w różny sposób, zależnie od tego co to są za modyfikacje, w
którym miejscu i w jakim dokładnie histonie zaszły (występuje kilka rodzajów
histonów).
jak i modyfikacje chemiczne białek histonowych mogą być dziedziczone
(przekazywane podczas replikacji do potomnych komórek oraz zachowane w trakcie mejozy do następnego pokolenia: z
rodziców na dzieci, a nawet przez wiele dalszych pokoleń), zaszła potrzeba
naukowego zbadania tego procesu: w jaki sposób takie dziedziczenie zachodzi i
jaki ma wpływ na organizmy żywe, ich ewolucję biologiczną, czy ma jakiś
związek z występowaniem chorób albo predysponowaniem do występowania jakichś
cech anatomicznych, fizjologicznych czy zachowań.
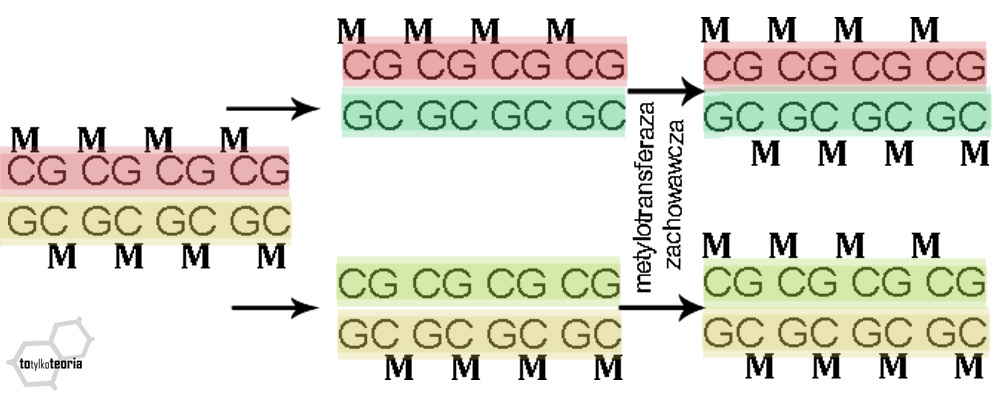
podczas podziału komórkowego prezentuje się dosyć prosto. Najpierw wzorcowa nić
DNA z komórki, która zaczyna się dzielić jest rozdzielana, a następnie
dobudowywana jest nowa, według zasady komplementarności (która mówi o tym, że
guanina łączy się z cytozyną, a adenina z tyminą, w związku z czym jeśli na
nici pierwotnej mamy np. sekwencję tymina-adenina-adenina, to dobudowana
zostanie nić adenina-tymina-tymina). Na starej nici zachowana zostaje
metylacja, a enzym metylotransferaza zachowacza do nici doreplikowanej dołącza
w analogicznych miejscach grupy metylowe. Trudniej jest wytłumaczyć
dziedziczenie z pokolenia na pokolenie: od rodziców do dzieci, ponieważ w
trakcie powstawania komórek płciowych (oocytów i plemników) wzór metylacji DNA
jest usuwany (nazywa się to procesem demetylacji), tak samo jak na początkowych
etapach rozwoju zarodkowego.
 |
| Dziedziczenie epigenetyczne z udziałem metylotransferazy zachowawczej |
Piętnowanie gametyczne: epigenetyczne programowanie zarodka
Okazuje się jednak, że
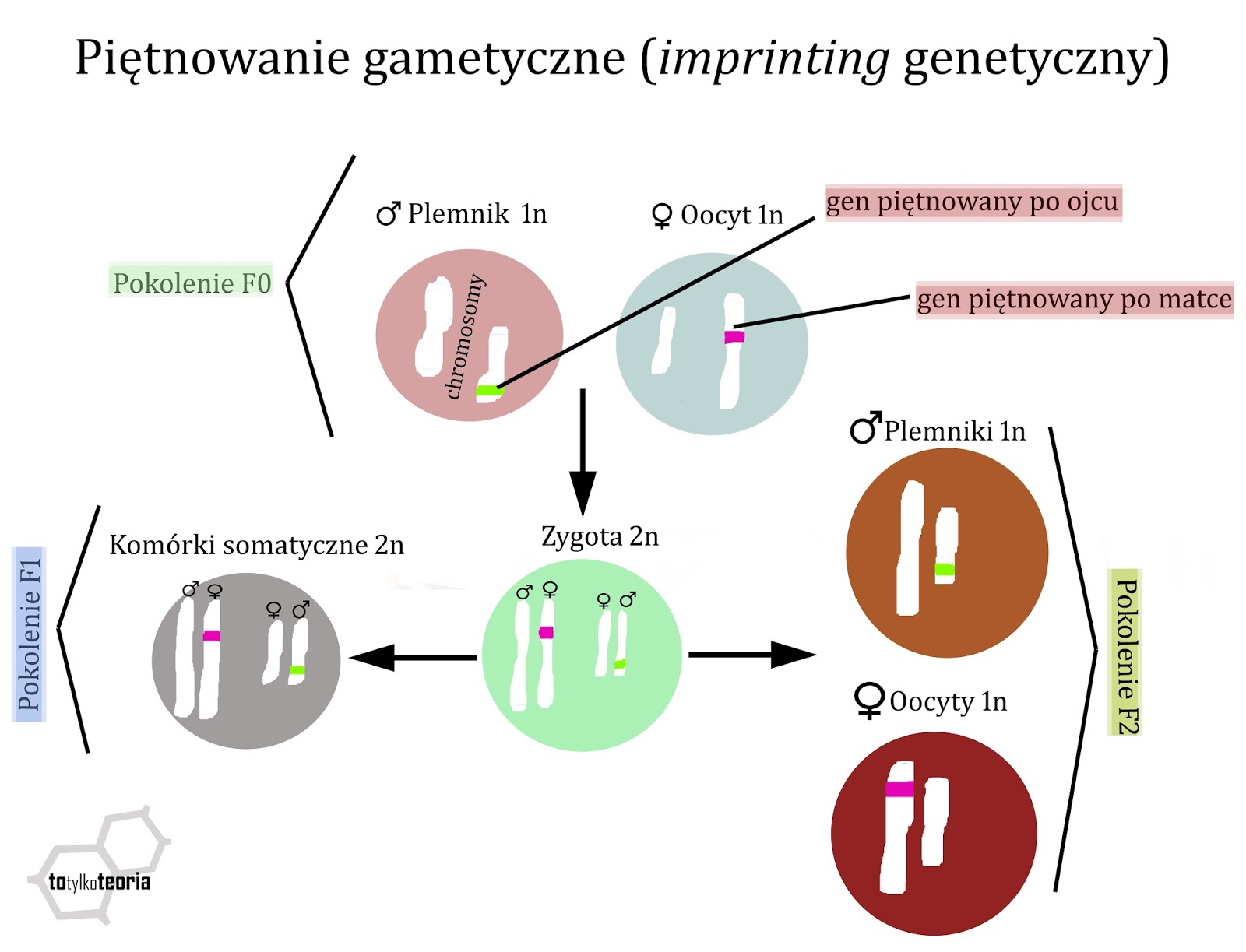
niezupełnie. Po pierwsze, istnieje zjawisko piętnowania gametycznego,
nazywanego też imprintingiem. Gen piętnowany to taki, który jest silnie
metylowany i nie ulega ekspresji wcale lub ulega w niewielkim stopniu. Niektóre
geny piętnowane są po ojcu, a inne po matce. W diploidalnym genomie (czyli 2n –
taki, który składa się z dwóch zestawów chromosomów, po jednym od każdego z
rodziców) część genów piętnowana jest ze strony matki, a część ojca. Natomiast
plemniki i oocyty są haploidalne – mają tylko jeden zestaw chromosomów. To,
które geny będą tutaj piętnowane (metylowane), zależy od płci rodzica. Czyli
plemniki będą miały metylację genów piętowanych po ojcu, a oocyty – po matce. W
komórce jajowej oba haploidalne genomy (z plemnika i oocytu) łączą się, stając
się diploidalną zygotą, w której znów część genów posiada piętno po jednym z
rodziców, a część po drugim. Gdy zygota rozwinie się w nowego osobnika i
zacznie zachodzić u niego gametogeneza (powstawanie komórek rozrodczych) to
cały cykl się powtarza. Piętnowanie gametyczne występuje u ssaków i ma duże
znaczenie dla ich rozrodu. Uniemożliwia np. rozmnażanie partenogenetyczne.
 |
| Piętnowanie gametyczne (imprinting) |
poza piętnowaniem gametycznym istnieją także inne sytuacje, kiedy metylacja DNA
nie jest usuwana w trakcie mejozy (gametogenezy, powstawania oocytów i
plemników) i pierwszych etapów rozwoju zarodkowego i może być dziedziczona do
następnego pokolenia. Jeśli określony wzór metylacji DNA powstanie w komórkach
rozrodczych lub też zostanie im przekazany zanim się wykształcą w trakcie
rozwoju zarodkowego i organogenezy, jest szansa, że nie ulegnie demetylacji i
ujawni się u potomstwa.
Dziedziczenie epigenetyczne: wewnątrzpokoleniowe i międzypokoleniowe
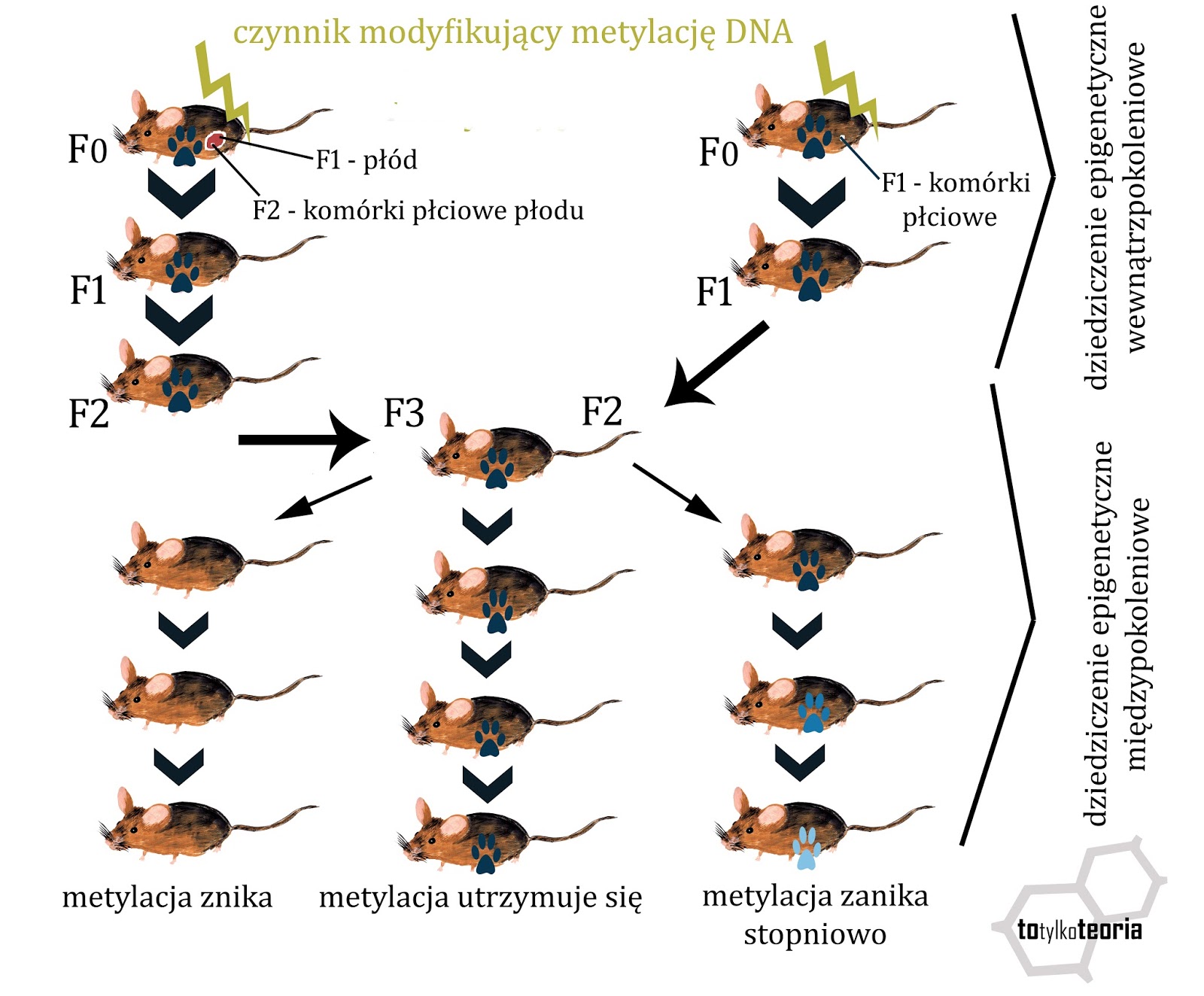
dzieli się na wewnątrzpokoleniowe oraz międzypokoleniowe. To pierwsze dotyczy
dziedziczenia wzoru metylacji DNA w sytuacji, gdy powstał on w odpowiedzi na
czynnik działający bezpośrednio na dane pokolenie. W przypadku ciężarnych samic
działał on więc na pokolenie F0 (ciężarna), F1 (zarodek lub płód) oraz F2
(komórki generatywne płodu lub komórki zarodka, które w komórki płciowe się za
chwilę rozwiną). Dopiero pokolenie F3 (prawnuk ciężarnej) będzie tym, na które
czynnik wywołujący modyfikacje epigenetyczne nie zadziałał bezpośrednio i jeśli
taka modyfikacja wystąpi także u tej generacji, to mówimy już o dziedziczeniu
epigenetycznym międzypokoleniowym. Jeżeli natomiast czynnik modyfikujący
metylację zadziałał na samicę nie będącą w ciąży lub na samca, to miał on
bezpośredni wpływ tylko na pokolenie F1, czyli komórki płciowe (plemniki i
oocyty), z których powstanie pokolenie F2, będące w tym układzie już w zasięgu
dziedziczenia epigenetycznego międzypokoleniowego. Ten ważny, funkcjonalny
podział dziedziczności epigenetycznej obrazuje poniższy rysunek.
 |
| Dziedziczenie epigenetyczne wewnątrzpokoleniowe i międzypokoleniowe |
Przede wszystkim ma znaczenie w powstawaniu nowych gatunków roślin, których
genomy poliploidyzują (czyli powielają się np. do 3n, 4n, 5n itd.), a następnie
są metylowane. Ponieważ metylacja DNA powoduje zmiany fenotypu (czyli np.
zmiany budowy ciała, zabarwienia, fizjologii, zachowania), to podlega doborowi
naturalnemu. Przykładowo, jeśli jakiś czynnik spowoduje, że geny odpowiedzialne
za pigmentację będą słabiej ulegały ekspresji przez podwyższoną ich metylację,
a środowisko, w którym nosiciele tychże genów funkcjonują, wymaga ciemniejszego
umaszczenia (np. ze względu na to, że takiego koloru są kryjówki i ułatwia to
skrycie się przed drapieżnikami), to podwyższona metylacja będzie w tym
przykładzie eliminowana, gdyż wykazujące ją osobniki będą częściej zjadane, a
rzadziej będą się rozmnażać.
wewnątrzpokoleniowe może przełożyć się na krótkotrwałe przystosowanie do
środowiska i tym samym odgrywać pewną rolę w ewolucji populacji. Przykładów dziedziczenia
epigenetycznego poznano niewiele, choć z roku na rok liczba ta rośnie. Można by
wymienić tutaj dziedziczenie lęku: myszy, które
rażono prądem, co skojarzone było z zapachem róży (acetofenonem) miały
zmienioną metylację genu kodującego receptor węchowy M71 w węchomózgowiu i
zmiana ta była dziedziczona co najmniej do trzeciego pokolenia, a ponieważ
drażnieniu prądem poddawano samce, oznacza to, że od pokolenia F2 było to
dziedziczenie międzypokoleniowe. Innym znanym przykładem dziedziczenia
epigenetycznego były modyfikacje genów odpowiedzialnych za metabolizm m.in.
tłuszczów, które wystąpiły u płodów niedożywionych ciężarnych w trakcie zimy
głodu z 1944/1945 w Holandii. Sądzi się też, że czynniki epigenetyczne biorą
udział w różnicowaniu się orientacji
psychoseksualnych. Spektakularny wynik uzyskano przy badaniu nicieni, które aż
przez co najmniej 40 pokoleń specyficznie reagowały na zapach, którym zostały
uczulone w pierwszym pokoleniu. Podobne efekty można by potencjalnie uzyskać u
ssaków, ale mamy tutaj trudność w postaci dłuższej przemiany pokoleń (u
badanych nicieni trwa to raptem około 20 dni) – taki eksperyment potrwałby
wiele lat i kosztował duże pieniądze.
 |
| Holenderki podczas zimy głodu z 1944/1945, National archief, http://www.gahetna.nl |
ciekawą rzecz. Przekonanie o tym, że cech nabytych nie można dziedziczyć stało
się niemalże dominującym poglądem w XX wieku. Przyczyną tego były eksperymenty
Augusta Weismanna, który obcinał myszom ogony i sprawdzał, czy skrócony ogon
będzie odziedziczony. Tak się oczywiście nie działo. W tamtych czasach przez
brak dostępu do technik biologii molekularnej naukowcy nie byli w stanie przewidzieć
tego typu pułapki czyhającej na wyciągane przez nich wnioski. Dziś wiadomo, że
dziedziczenie rozumianych epigenetycznie cech nabytych może się odbywać właśnie przez dziedziczenie
epigenetyczne i przykładem tego jest przekazanie „lęku” (metylacji powodującej
stosowne zmiany w aktywności receptorów węchowych w odpowiedzi na dany zapach) potomstwu
u myszy. Jest to nadal zjawisko słabo zbadane, ale wiemy, że występuje.
Ponieważ hipotezę dziedziczenia cech nabytych głosił aktywnie Lamarck, to
proces ten nazywa się też dziedziczeniem lamarkistowskim lub ewolucją
lamarkistowską. Był on botanikiem, a jak wspomniałem, u roślin dziedziczenie
epigenetyczne i cech nabytych jest znacznie bardziej wyraźne, stąd nie dziwi
fakt, że to botanicy pierwsi zwrócili na nie uwagę.
Choroby epigenetyczne
metylacja DNA, która pozwoliła na wyewoluowanie mechanizmów jej dziedziczenia?
Zjawisko to występuje już u bakterii i uważa się, że pojawiło się i utrzymało,
ponieważ pozwalało na dezaktywację genów wirusowych, atakujących bakterie.
Obecnie też tak się dzieje i to nie tylko u prokariontów. W świecie ssaków
wirusy i ruchome sekwencje DNA, pochodzące od wirusów, które kiedyś, w toku
ewolucji, wbudowywały się w genomy, również są metylowane. Gdyby mogły się
poruszać, powodowałyby zmiany sekwencji DNA, czyli mutacje i prowadziły do
rozwoju nowotworów czy osłabienia układu odpornościowego. Dlatego zaburzenia
metylacji DNA właśnie do takich zaburzeń prowadzą. Mogą przyczyniać się np. do
zachorowania na ostrą białaczkę szpikową. Chorób związanych z epigenetyką jest
więcej i należą do nich np. Zespół Angelmanna, Zespół Pradera-Williego czy zaśniad groniasty.
 |
| Zaśniad groniasty, Gillain Boivin, XVII/XIX wiek |
histonów prawdopodobnie odgrywają także rolę w starzeniu się organizmów.
Przeprogramowanie komórek zróżnicowanych, np. skórnych, w komórki zarodkowe, wiąże
się m.in. ze zmianą modyfikacji epigenetycznych i to one powodują, że choć i
komórka naszego mózgu i wątroby, czy nerki ma takie samo DNA, to jej morfologia
i funkcjonalność są często zupełnie inne – po prostu różne geny w
poszczególnych typach tkanek są aktywne.
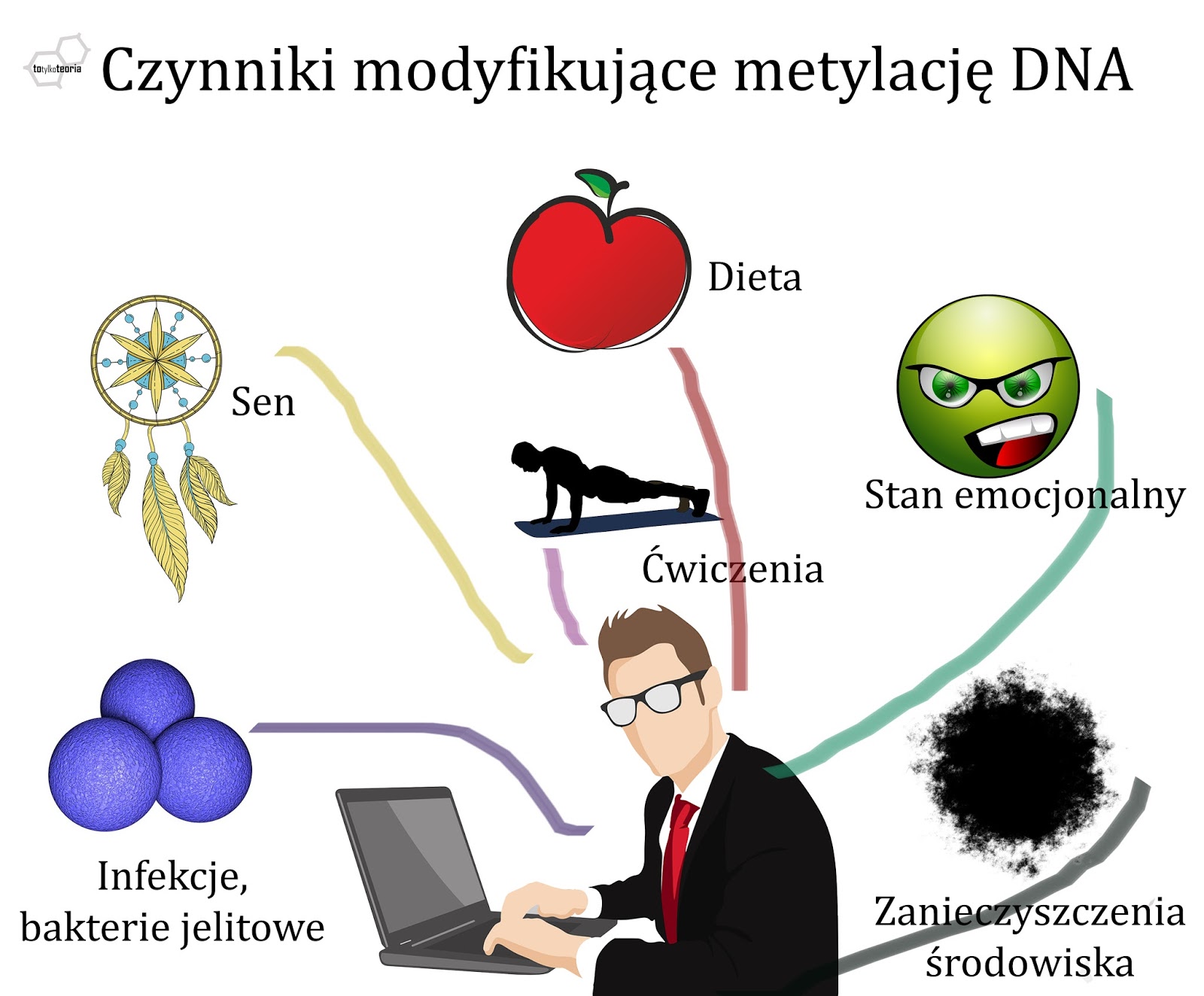
Dieta i epigenetyka. Czy jedzeniem możemy zmienić metylację DNA?
Kolejnym wyzwaniem jest ustalenie
tego, w jaki sposób określone czynniki środowiskowe wpływają na metylację DNA i
modyfikacje histonów i jak to się przekłada na nasze cechy. Wiadomo na
przykład, że obniżona zawartość witaminy B11 (kwasu foliowego) czy
witaminy B12 (kobalaminy) powoduje zaburzenia metylacji, a dzieje
się tak, ponieważ oba te związki są donorami (dawcami) grup metylowych do
reakcji związanych z metylacją DNA i białek. Przykładowo niedobór kwasu
foliowego wywołuje zaburzenia metylacji limfocytów u kobiet, co można odwrócić
dzięki suplementacji. U myszy Agouti
brak grup metylowych w diecie skutkuje uwolnieniem transpozonu (wspomnianej już
wyżej, ruchomej sekwencji DNA pochodzenia wirusowego) i wywołaniem mutacji
zmieniającej umaszczenie. Ustalono również, że niedobór selenu zmienia profil
metylacji DNA w wątrobie oraz w jelicie grubym, a galusan epigallokatechiny
(który znajduje się np. w zielonej herbacie) blokuje
działanie enzymów – metylotransferaz – które dołączają grupy metylowe do
cząsteczek. Chomikom, które naraża się na działanie światła nocą, ujawniają się
zaburzenia hormonalne i rozregulowanie metylacji DNA w śledzionie. Niektóre z
powyższych wyników są wstępne, inne – jak te dotyczące kwasu foliowego – dobrze
potwierdzone. Dziedzina, która zajmuje się badaniem wpływu składników
pokarmowych na ekspresję genów to nutrigenomika.
przykłady można odnieść wrażenie, że dzięki mechanizmom epigenetycznym możemy
zmieniać ekspresję swoich genów tak, że jakaś określona cecha wystąpi u nas
albo nie, nasili się lub osłabi, że zachorujemy na coś bądź też nie, a może
nawet będziemy bardziej odporni. Jest to wniosek na pewno w jakimś stopniu
słuszny, ale dziedziczenie epigenetyczne i wpływ czynników środowisk na
metylację DNA i histonów są wciąż na tyle słabo poznane, że trudno o
uniwersalne i pewne wnioski, układające się w szerszą teorię naukową. Niestety
temat ten już zdążyli wykorzystać do swoich celów różnego rodzaju znachorzy,
szarlatani, pseudokołcze od mocy pozytywnego myślenia i inni wszelkiej maści
naciągacze i oszuści, którzy swoim klientom, wyznawcom czy fanom wmawiają, że
ten czy inny suplement albo taka czy inna sesja pozytywnego myślenia, zmieni
epigenetycznie ekspresję ich DNA tak, że będą zdrowsi i szczęśliwsi.
programowanie epigenetyczne za pomocą czynników środowiskowych jest możliwe i
poświęca się mu różnego rodzaju badania i analizy, ale z pewnością nie polega
ono na tym, o czym wyżej. Potrzeba konkretnych badań i mocnych dowodów, że ten
lub tamten związek chemiczny w pożywieniu, jakieś ćwiczenie fizyczne albo
słuchanie takiej czy innej muzyki zmienia w korzystny sposób profil metylacji
DNA albo białek histonowych. Wyciąganie od ludzi dużych pieniędzy za coś o
niepotwierdzonym działaniu i podtrzymane wątpliwej jakości argumentami
naukowymi, jest po prostu nieetyczne.
Epigenetyka, ewolucja biologiczna i epigenetyczni szarlatani
kilka ważnych i fascynujących aspektów metylacji DNA. Pierwszym z nich jest jej
wpływ na ewolucję biologiczną. W podręcznikach do biologii ewolucyjnej,
genetyki czy zoologii albo botaniki wciąż znajdują się zapisy o tym, że
źródłami zmienności są: rekombinacja (crossing-over
podczas mejozy i łączenia się DNA męskiego i żeńskiego w komórce jajowej),
mutacje genetyczne oraz horyzontalny transfer genów (czyli np. wymienione już
sekwencje pochodzenia wirusowego albo od endosymbiontów). Z badań ostatniej
dekady wynika jednak, że choć czynniki epigenetyczne nie stanowią bezpośrednio
sekwencji DNA, to wpływają na nią (np. blokując lub umożliwiając zachodzenie
mutacji z udziałem transpozonów), a także na jej ekspresję, co ma kluczowe
znaczenie. Z tego też powodu niektórzy za kolejny fundamentalny element
zmienności w ewolucji uznają modyfikacje i dziedziczenie epigenetyczne.
zdecydowanie bardziej w modzie, odnosi się do modyfikacji metylacji naszego DNA
różnymi czynnikami środowiskowymi tak, by korzystnie wpływało to na nasze
zdrowie, a także w przypadku ciężarnych – na zdrowie płodu i przyszłą jakość
życia dziecka. Trzeba tu jednak dodać, że ze względu na istnienie dziedziczenia
epigenetycznego, zwłaszcza międzypokoleniowego, również czynniki środowiskowe
mające na nas wpływ przed poczęciem, będą działały pośrednio na nasze
przyszłe dzieci. Dotyczy to również naszych wnuków i potencjalnie nawet
prawnuków. Może się na przykład okazać, hipotetycznie, że paląc papierosy od
15. roku życia wymusimy zmiany metylacji
naszego DNA, a te zostaną odziedziczone i nasze dzieci oraz kolejne pokolenia
będą miały przez to predyspozycję do uzależnienia od nikotyny.
w stylu „Dopóki nie jestem w poważnym związku i nie planuję dzieci, mogę robić
co chcę: źle się odżywiać, mało spać, dużo się stresować, pić alkohol i palić
papierosy. Zmienię się, jak poznam prawdziwą miłość albo gdy będę mieć dzieci.”
może być dla tych ostatnich zgubne, ale nie wyłącznie – metylacja naszego DNA
zachodzi nie tylko w oocytach i plemnikach, lecz potencjalnie we wszystkich
komórkach organizmu i modyfikacje takie mogą odbić się na naszym zdrowiu w
przyszłości. Wyobraźmy sobie, że jesteśmy bryłą. Nasze DNA określa, z jakiego
materiału ona jest, a zatem jaka jest jej twardość, kolor, tekstura. Bryłę tę
natomiast rzeźbią czynniki środowiskowe, za pomocą mechanizmów epigenetycznych
oraz plastyczności ludzkiego mózgu. Lubię tę metaforę.

Denise P. „Methylation and imprinting: from host defense to gene
regulation?” Science (1993): 309-311.
Sheila C., M. A. H. Surani, and M. L. Norris. „Role of paternal and
maternal genomes in mouse development.” Nature 1984): 374-376.
M. Turner. Chromatin and Gene Regulation: Molecular Mechanisms in Epigenetics.
Blackwell Science, Oxford 2001.
Benjamin R., et al. „Paternally induced transgenerational environmental
reprogramming of metabolic gene expression in
mammals.” Cell 143.7 (2010): 1084-1096.
Yasmine M., Kathryn LG Russart, and Randy J. Nelson. „Parental Exposure to
Dim Light at Night Prior to Mating Alters Offspring Adaptive
Immunity.” Scientific Reports 7 (2017): 45497.
Lucia, and Emma Whitelaw. „Understanding transgenerational epigenetic
inheritance via the gametes in mammals.” Nature Reviews Genetics
(2012): 153-162.
Villena, Fernando Pardo-Manuel, Elena de la Casa-Esperón, and Carmen Sapienza.
„Natural selection and the function of genome imprinting: beyond the
silenced minority.” TRENDS in Genetics (2000): 573-579.
Ressler. „Parental olfactory experience influences behavior and neural
structure in subsequent generations.” Nature neuroscience (2014): 89-96.
J. Futuyma. Ewolucja. Wydawnictwo Uniwersytetu Warszawskiego. Warszawa
2005.
Amr Rafat. „Role of DNA methylation in imprinting disorders: an updated
review.” Journal of Assisted Reproduction and Genetics (2017):
1-14.
Suhua, et al. „Conservation and divergence of methylation patterning in
plants and animals.” Proceedings of the National Academy of Sciences
(2010): 8689-8694.
S., F. Boller, and K. L. Tyler. „Historical aspects of the major
neurological vitamin deficiency disorders: the water-soluble B
vitamins.” History of Neurology (2009): 445.
Fletcher, I. Hickey, P. Winter. Krótkie wykłady. Genetyka. Wydawnictwo Naukowe
PWN. Warszawa 2013.
Edith, and Robert A. Martienssen. „Transgenerational epigenetic
inheritance: myths and mechanisms.” Cell (2014): 95-109.
Robert A., et al. „Moderate folate depletion increases plasma homocysteine
and decreases lymphocyte DNA methylation in postmenopausal
women.” The Journal of nutrition (1998): 1204-1212.
Frank, et al. „Assessing the impact of transgenerational epigenetic
variation on complex traits.” PLoS Genet (2009): e1000530.
J. K., Mala Samaranayake, and Sriharsa Pradhan. „Epigenetic mechanisms in
mammals.” Cellular and molecular life sciences (2009): 596.
R. C., et al. „Transgenerational effects of prenatal exposure to the Dutch
famine on neonatal adiposity and health in later life.” BJOG: An
International Journal of Obstetrics & Gynaecology (2008): 1243-1249.
Ariane. „Epigenetics in reproductive medicine.” Pediatric
research 61 (2007): 51R-57R.
Jean-Jacques. „Stable inheritance of an acquired behavior in
Caenorhabditis elegans.” Current Biology (2010): R877-R878.
Maria Rogalska, Magdalena Achrem, Andrzej Wojciechowski. Chromatyna.
Molekularne mechanizmy epigenetyczne. Wydawnictwo Uniwersytetu Przyrodniczego w
Poznaniu. Poznań 2010.
Catherine M., Dario Boffelli, and David IK Martin. „A role for epigenetic
inheritance in modern evolutionary theory? A comment in response to Dickins and
Rahman.” Proceedings of the Royal Society of London B: Biological
Sciences (2013): 20130903.
Marjolein VE, et al. „Transgenerational effects of prenatal exposure to
the 1944–45 Dutch famine.” BJOG: An International Journal of Obstetrics
& Gynaecology (2013): 548-554.
Michael, et al. „Distribution, silencing potential and evolutionary impact
of promoter DNA methylation in the human genome.” Nature genetics
(2007): 457-466.









„Może się na przykład okazać, hipotetycznie, że paląc papierosy od 15. roku życia wymusimy zmiany metylacji naszego DNA, a te zostaną odziedziczone i nasze dzieci oraz kolejne pokolenia będą miały przez to predyspozycję do uzależnienia od nikotyny.”
A dlaczego nie wrodzony wstręt do nikotyny? Przecież zmiany epigenetyczne są bezkierunkowe, jak mutacje. Czemu zmiana wywołana fizjologicznym stresem powodowanym przez obecność trucizny miałaby wywoływać akurat preferencję na tę truciznę, a nie np. skłonność do wczesnego łysienia albo niechęć do zapachu fiołków?
Rzecz właśnie w tym, że zmiany epigenetyczne niekoniecznie muszą być przypadkowe, jak mutacje.
W takim razie co steruje ich kierunkowością? Tego nie zrozumiałem.
Żeby zmiany epigenetyczne mogły mieć skutek generalnie nieobojętny, np. pozytywny (powiedzmy: efektywniejsze trawienie tłuszczów u potomków głodującej przodkini) albo negatywny (preferencja na nikotynę) raczej niż przypadkowy, te cząsteczki musiałyby być niesamowicie mądre, by rozumieć zachodzący kilka poziomów wyżej wpływ środowiska na organizm.
Może być pewnie tak, że metylacja następuje głównie tam, gdzie właśnie podczas stresu zachodzi translacja na RNA (bo pewnie trudniej zmetylować zasady póki pozostają ciasno zwinięte w chromosomach), ale jeśli metylacja blokuje ekspresję, to by skutkowało tylko tym, że dziecko palaczki miałoby obniżoną tolerancję na nikotynę, a nie preferencję na nią (bo skoro w reakcji na szkodliwy czynnik komórka coś robi, to najpewniej dla zniwelowania wpływu tego czynnika, więc jeśli komórka u potomstwa robi to mniej wydajnie, czynnik będzie działał silniej). Ale to z kolei powinien wycinać stary dobry dobór, bo jak ktoś ma zmniejszoną tolerancję na nikotynę, to dostanie raka jeszcze przed trzydziestką i nie doczeka się dzieci, więc pokolenie F5 nie zaistnieje.
Pytasz o to, dlaczego np. przy głodzie geny metabolizmu tłuszczów są metylowane tak, by prowadzić potencjalnie np. do zwiększenia gromadzenia tłuszczu? Co bezpośrednio odpowiada za kierunkowość? Mogą to być różne rzeczy, np. niedobór grup metylowych w diecie i niedmetylowanie albo inhibitory metylotransferaz w diecie.
No ale w takim razie wracamy do bezkierunkowości, bo brak czy nadmiar grup metylowych będzie tak samo działał wszędzie w genomie, nie tylko w okolicy genów mających związek z głodem czy jedzeniem. Będzie analogicznym czynnikiem, jak np. twarde promieniowanie dla normalnych mutacji – stymuluje je, ale nie oczekujemy, że te mutacje będą zwiększać czy zmniejszać odporność na promieniowanie.
Wydaje mi się, że kierunkowość jest tutaj powodowana stałym narażeniem na dany czynnik o działaniu, powiedzmy, metylującym. Mówiąc wprost i czepiając się palenia- dziecko osoby palącej będzie miało większe prawodpodobieństwo już na starcie, że też stanie się nikotynistą i samo zapewni w ten sposób kierunkowość między generacjami. A jeśli chodzi o jedno życie pojedynczego człowieka to kierunkowość zmian jest powodowana przez tzw. metylotransferazy zachowawcze, odpowiedzialne za nałożenie "nowego" starego piętna. Za przypadkowość metylacji odpowiadają inne metylotrasferazy indukowane innymi czynnikami w porównaniu do zachowawczych. Jest jeszcze jedna rzecz, którą pomyliłeś, nadmiar grup metylowych w genomie nie będzie działał tak samo w całym genomie jak w obrębie poszczególnych genów. Nawet dalej- poziom zmetylowania niektórych genów będzie tkankowo specyficzny. Ten sam gen eksprymowany w mózgu będzie miał inny poziom metylacji niż ten, który uległ ekspresji np. we krwi (autyzm).
Epigenetyka jest sprzeczna z darwinowska ewolucją ponieważ jest to norma reakcji na środowisko dzięki już istniejącym genom, które mogą się przeprogramować w odpowiedzi na presję środowiska nie ma tutaj przypadkowych zmian które utrwalają się w doborze naturalnym. Nie ma tutaj także powstawania czegoś od nowa. Potencjał genetyczny zdolny do takich zmian istniej od początku.
W ogole gowniano napisane,bo widać w tym Twoją nie wiarę jak i pr0be negowania tematu.
Same przekonania ma największy wpływ na życie! A nie, ze jakieś suplementy. Warto to poczuc A nie tylko te0retycznie podejść. Zmień jakies przekonanie i obserwuj jak zmienia się Twe zycie.